WFT1 #01 鱼眼中的世界

What Fish Tells (WFT) 前言:
注:本文来自微信公众号"森林鱼塘",此系列的所有内容欢迎关注公众号查看!欢迎学术讨论!
如何研究大脑?我们可以将大脑类比于电脑。倘若我把码这篇文章的Win10系统台式电脑用时光机送回一百年前,当时的科学家会如何研究它?
把电脑全部拆成最小零件,研究单个晶体管产生原理、电学性质,通过与(And)、或(Or)、异或(Xor)、非(Not)门输出信息的正是目前研究单个神经元电生理内禀性或简单神经环路发育与功能的生理或分子生物学家;
把整块CPU全部打开,研究其核心集成电路连接图谱,以及探究各种微环路如何设计行使基本功能,是线虫派神经科学家的做法,目前线虫全部302个神经元的功能与连接已基本清楚。
研究主板上CPU(大脑)与显卡(视觉),声卡(听觉)等其他硬件间如何信息交互,并且进一步研究在这框架上发展起来的基本操作系统框架的,是目前斑马鱼派(可认为DOS系统,或早期Windows系统)和果蝇派(早期Linux系统)神经科学家的基本做法。
在外部环境信息的不断更新下,大脑的操作系统进一步迭代升级,研究Windows系统上各种高级功能,是啮齿类派(Win 95),非人灵长类派(Win XP),疾病人脑模型派(Win 7),正常人认知心理学派(WIN 10)神经科学家的做法。
学派间无孰优孰劣,神经科学家们的最终目标都是为了揭示大脑的奥秘,只是入手角度各有千秋。鱼类为脊椎动物,其大脑虽小,但基本功能俱全,可以捕食与逃跑,也具有丰富的社交行为。斑马鱼作为一种全脑透明的硬骨鱼类,结合目前光学手段能够很轻易地在全脑层面上对单神经元分辨率的成像与操控,相当于所有硬件电路的设计图以及底层机器码已开源,剩下的,就只剩读懂它们。
本篇文章为“What Fish Tells”研讨会的第一篇文章,欢迎大家前去关注微信公众号”森林鱼塘“,那里有完整的WFT第一期的内容,以斑马鱼为模式生物,涵盖神经科学研究领域的基本内容和最新进展,希望能和读者共同走进神经科学和类脑智能的世界,感受探索未知和思考的乐趣。
第一期:视觉(从视网膜到视顶盖)
斑马鱼视觉-运动的整体框架总览如下图一[1]所示:
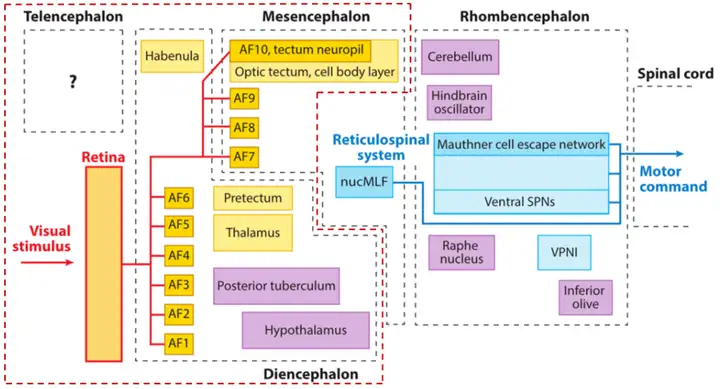
黄色部分表示直接接受视觉输入,蓝色部分主要控制运动输出,紫色部分参与调控视觉运动转换过程,本期我们将重点放在红色虚线包围的框架内,着重分析视觉环路的信息处理。
一、视网膜(Retina)
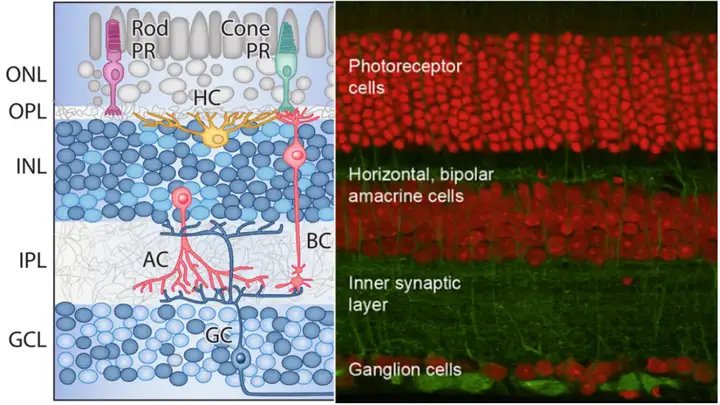
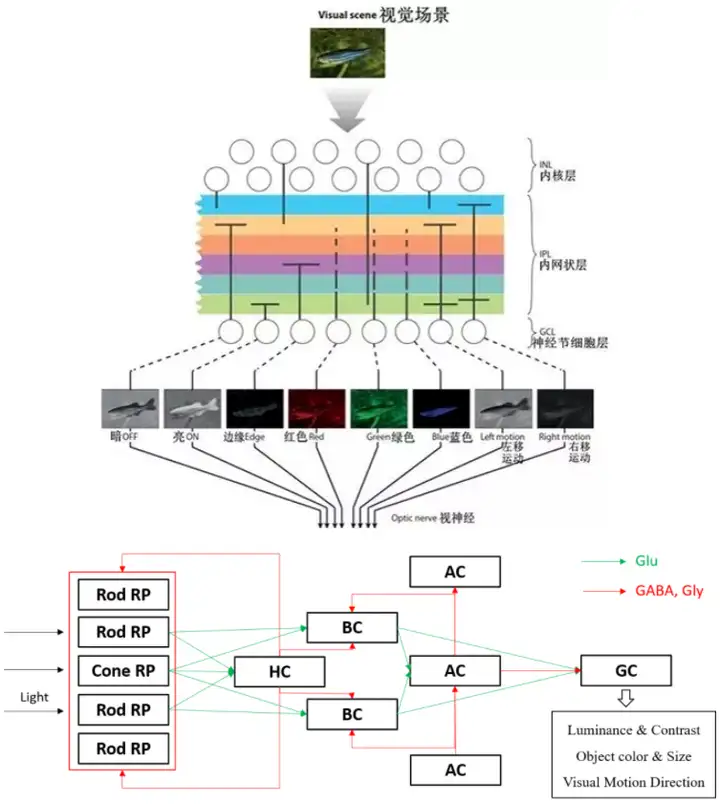
斑马鱼视网膜在组织结构与神经元类型上与人相差不大。按组织结构可分为五层,由外至内分别是外核层(Outer Nuclear Layer, ONL),外网状层(Outer Plexiform Layer, OPL),内核层(Inner Nuclear Layer, INL),内网状层(Inner Plexiform Layer, IPL),神经节细胞层(Ganglion Cell Layer (GCL)。并且存在五种经典的神经元类型,由外至内分别是光感受器(Photoreceptor, PR),水平细胞(Horizontal Cell, HC),双极细胞(Bipolar Cell, BC),无长突细胞(Amacrine Cell, AC),神经节细胞(Ganglion Cell, GC),具体结构如下图二所示[1]:
果蝇的视网膜的组织结构与投射脑区与脊椎动物存在很大差异,属于进化两个不同方向,因此类比为早期Linux系统,而斑马鱼与高等哺乳类的视网膜结构高度相似,视觉信息的输出投射也具有一定的相似性,因此类比为Windows系统的早期和晚期,详细结构如下图三[3]所示:
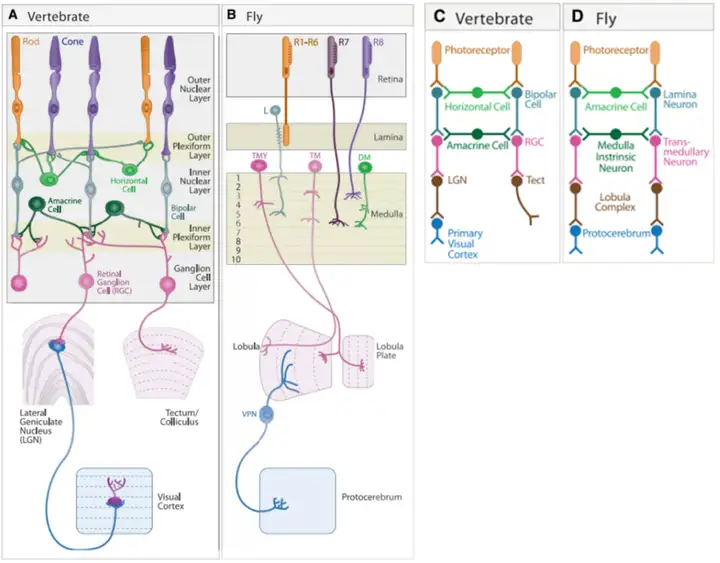
图三可知脊椎动物的视网膜完成对视觉信息的处理后会有两条下游通路,一条以外侧膝状核(Lateral Geniculate Nucleus, LGN)为中继站投向视皮层(Visual Cortex, VC), 另一条直接投向一个高度保守的视觉中枢,在低等脊椎动物中叫视顶盖(Optic Tectum, OT), 高等脊椎动物中叫视上丘(Superior Colliculus, SC),视顶盖的结构与功能后面会提到,先来简单介绍下视网膜五种经典的神经元类型:
光感受器(Photoreceptor, PR):分为视锥细胞(Cone PR)和视杆细胞(Rod PR)。视锥能够感受强光和颜色,并且每一个视锥都会有独立吸收光谱;视杆对光线比较敏感,能够感知弱光,在大多数脊椎动物的眼中视杆数量约为视锥的20倍,每个视杆都只有一种感受光的蛋白质,即视紫红质(Rhodopsin, Rh)。视紫红质遇光构象转变为反型视黄醛,激活视蛋白,与其偶联的G蛋白激活蛋白激酶,活化环磷酸鸟苷(cyclic guanosine monophosphate, cGMP);视紫红质在暗处合成速率大于分解速率,因而弱光状态下胞浆内含cGMP,因而持续激活细胞膜上cGMP门控钠通道,钠离子持续内流,使视杆静息电位为去极化电位,末端持续激活释放谷氨酸;接受光照时,视紫红质激活传导蛋白(transducin, Gt),进而激活磷酸二酯酶(Phosphodiesterase,PDE),将cGMP分解,cGMP门控钠通道关闭,细胞超极化,谷氨酸释放减少。
(小科普:人们常说的三原色是因为人类视网膜内存在大量对红绿蓝三色波长敏感的视锥,而狗和小鼠的视网膜内缺少对红色波长段敏感的视锥,因此它们的世界里缺少了红色。牛的眼中视锥很少,因此对它来说这个世界几乎是黑白的,它可能只是想顶斗牛士手上飘动的布,而不是红色的物体。斑马鱼是种四原色动物,除了RGB三色之外,其视网膜还多了对紫外UV敏感的视锥[4]。皮皮虾有16种视锥,可以比美妆博主更好的分辨出各种口红的色号。)
水平细胞(Horizontal Cell, HC): PR感光后一般进行超极化释放兴奋性神经递质,即谷氨酸(Glutamate,Glu),而水平细胞为了将输入信号控制在一定范围内就会产生抑制性反馈与前馈作用于视锥视杆以及双极细胞上,神经递质为γ-氨基丁酸(Gamma-aminobutyric Acid, GABA)。
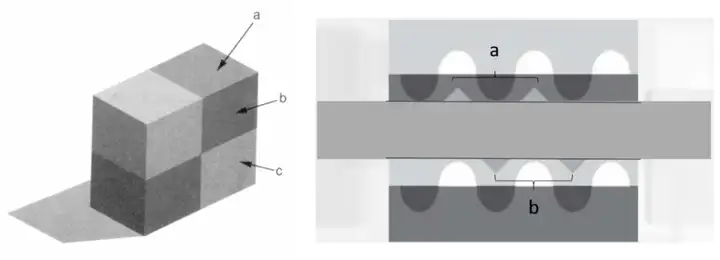
(小科普:试想你在一个黑暗的房间中只有一盏超明亮的白炽灯亮着,当你用老式相机拍摄的时候照片很容易因为灯的光太强而产生过曝,使照片上灯光周围的景色全部曝白,而我们的眼球设计则避免了过曝,HC会压制白炽灯旁边光线亮度的信号输入,使我们仍能看到灯周围的景色。当然,这一设计偶尔也会带来一些错觉,同色色块在不同背景下会给人带来颜色不一的感觉,如下图四所示:
双极细胞(Bipolar Cell, BC): BC主要负责整合视锥视杆的连续信号,一个BC会整合多个视杆的信号输入,一个视杆也会被多个BC共享。按结构来分可将BC分为12类[5],其中11类接受视杆的输入,1类接受视锥的输入。按电生理特性可分为4类,分别是ON-sustained,OFF-sustained,ON-transient,OFF-transient, 因为神经节细胞主要对BC输入进行采样,因此神经节细胞的电生理特性也可分为以上四类。ON和OFF的差异主要在于谷氨酸受体的不同,OFF型双极细胞表达AMPA和kainate受体,阳离子通道会被谷氨酸打开;ON型表达mGluR6受体,谷氨酸与其结合时导致阳离子通道TRPM1关闭。
无长突细胞(Amacrine Cell, AC): AC主要是对BC的输出进一步精细化,选择性的过滤掉一些不必要的信息,使神经节细胞能够向大脑输出精准的视觉信息,也表达抑制型神经递质(GABA,Gly)调控双极细胞和神经节细胞的输入输出。其中有一类AC叫做星爆无长突细胞(Starburst Amacine Cell,SAC,星爆气流斩既视感),它与方向选择、物体运动识别有关。
神经节细胞(Ganglion Cell, GC): GC是视网膜最后的输出层,主要接受BC的直接输入及AC的调节,负责将视网膜内经过特征提取过的视觉信息传达到大脑内,从而对看到的事物做出适当的反应。在斑马鱼中GC会有10个树枝状的分支,称作树枝状区(Arborization Fields, AFs),不同结构与功能的GC会将不同的视觉特征传递到不同AF区[6]
小结:对于某个视觉场景特征(包括明暗,颜色,大小,方向等)的提取工作在视网膜这个五层神经网络上就已经完成,在斑马鱼中这些特征将被不同类型的GC送往不同的AF区,然后由下游的不同脑区解码这些特征使斑马鱼做出不同的行为,框架图如下图五所示:
二、树枝状区(AFs)
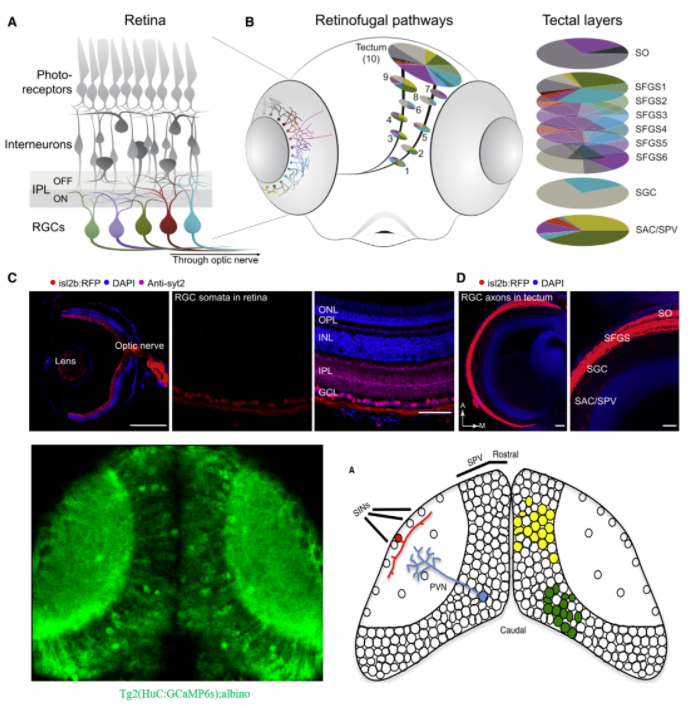
视网膜神经节细胞(RGC)在大脑中形成树枝状区AFs的结构如下所示[7],一共有10个区域,即AF1-AF10,其中AF10即视顶盖(Optic Tectum,OT)的neuropil区,视顶盖和哺乳动物上的视上丘同源,是由视顶盖神经元的神经纤维铺满的区域,结构如下图六所示:
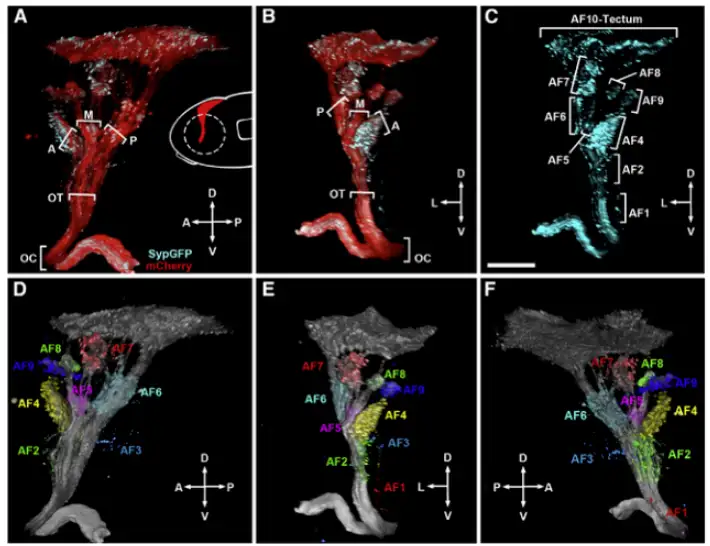
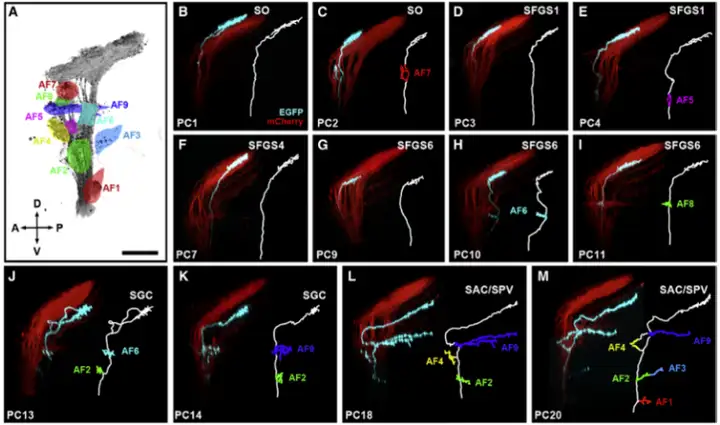
要注意的是,约97%的RGC轴突会在AF10处终结,绝大多数的视觉信息都会输入至OT区,剩下的3%会在AF9处终结,AF1-AF8只是RGC投射侧片长出去的旁支,分别输出小部分特征,RGC单细胞结构如下图七所示:
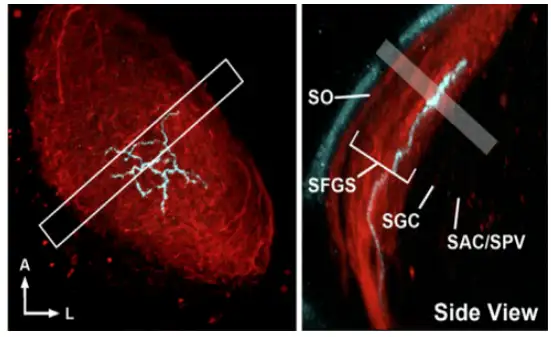
AF10投射的OT区一共分为9层,分别是视神经层(Stratum Opticum, SO),灰质纤维层S1-S6(Stratum Fibrosum et Griseum S1-S6, SFGS1-SFGS6),中央灰质层(Stratum Griseum Centrale, SGC),中央层和脑室周围层的边界层(boundary between the Stratum Album Centrale and the Stratum Periventriculare, SAC/SPV), 层级结构如下图八所示:
下面开始介绍各AF各区目前文献中已知输出的特征:
AF1-AF3目前功能不详细,但上世纪80年代金鱼(和斑马鱼一样属于硬骨鱼类)上的实验显示[8],AF1能够向下丘脑发送持续性的环境明暗信息,用以调节昼夜节律。
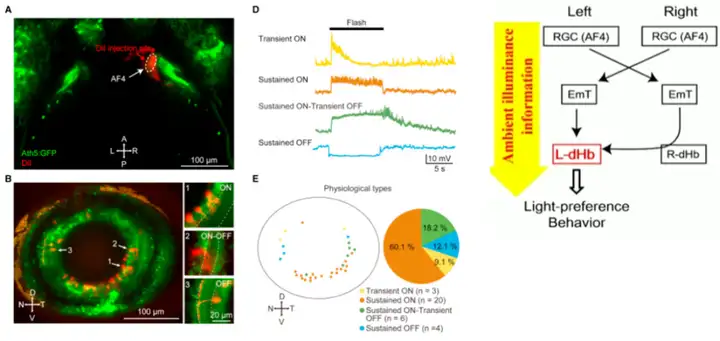
AF4已知能向丘脑隆起(Eminentia Thalami,EmT)输出Sustained-ON的信息,随后这部分信息偏好性输入至左侧缰核(Habenula, Hb),用以调节光偏好行为[9]。
AF5/6接受视网膜中方向性视网膜神经节细胞(Direction-Selective Retina Ganglion Cells, DS-RGC)的输入,用以感知环境中物体的运动方向[10,11]。
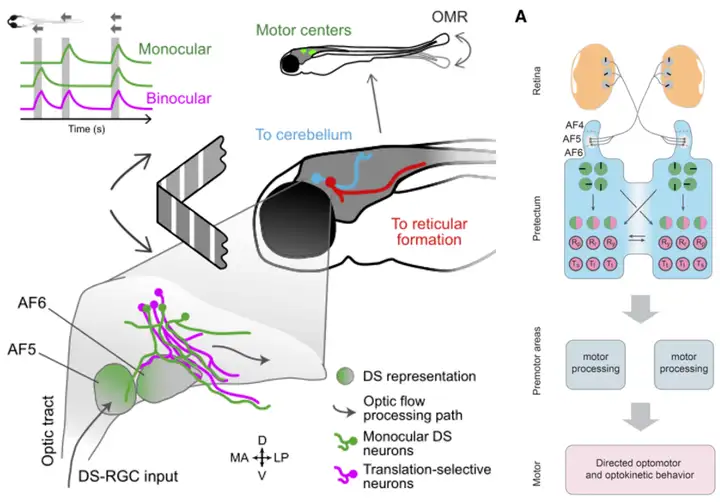
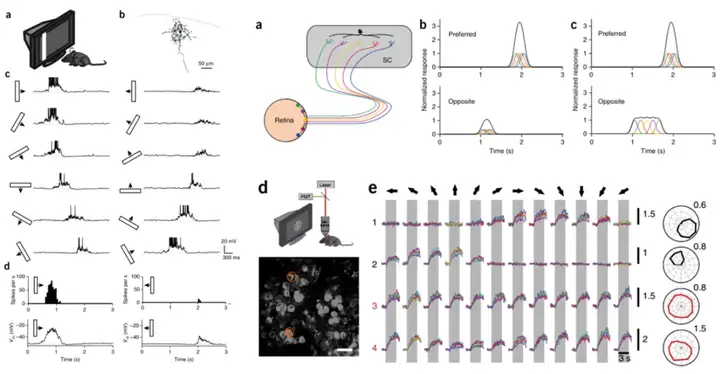
需要注意的一点是,并不是所有方向性信息都传递到AF5/6,大部分视觉信息都传递至OT。在小鼠的SC中也发现了方向选择性的神经元,并且其来源就是视网膜中的DS-RGC[12].
AF7主要对small-dot有反应,比如一些较小的猎物,如草履虫、轮虫等;AF9则是对big-dot有反应,如一些食物链顶端的捕食者(大鱼们)[13]。
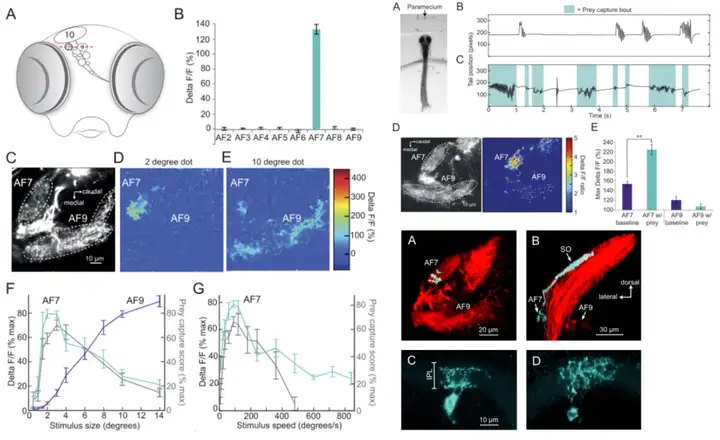
而AF6/8/9三个区域都对环境中的明暗变化非常敏感,尤其是对looming的反应强度要大于dimming刺激,可能还接受了部分边缘线性信息的输入[14]。
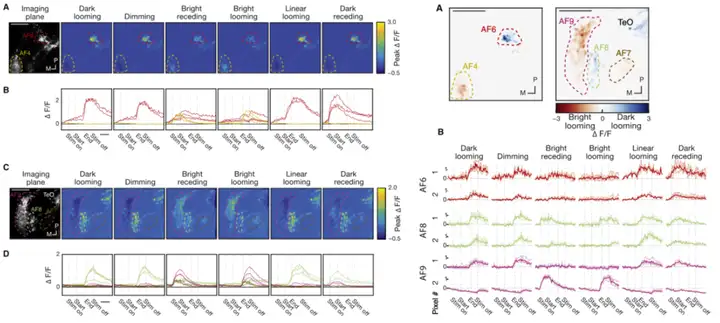
以上是目前AF区的一些研究进展,未来可能还会发现某AF区编码一些新的视觉信息,可以把注意力聚焦到AF区的下游,如视顶盖(optic tectum,OT)、顶盖前区(pretectum,preT)、丘脑(thalamus,Th)、下丘脑(hypothalamus,H)、缰核(Hb)等脑区。笔者认为,这些下游脑区的各类神经元如何调节视觉信息,是未来大可探索的方向。
三、视顶盖(OT)
视顶盖OT,哺乳动物视上丘的同源物,OT接受约97%RGC的输入,结构上主要分为9层,分别是: 视神经层、灰质纤维层S1-S6、中央灰质层、中央层/脑室周围层[15,16]。OT主要有两种类型的神经元:一种是室周神经元(Periventricular Neuron, PVN),其胞体主要位于脑室周围层,树突构成了Neuropil区,主要作用是负责接受并解码来自RGC的输入,也是OT中数量最多的神经元;另一类是表层抑制性神经元(Superficial Interneurons, SINs),绝大部分SINs的胞体位于OT最浅层的视层。
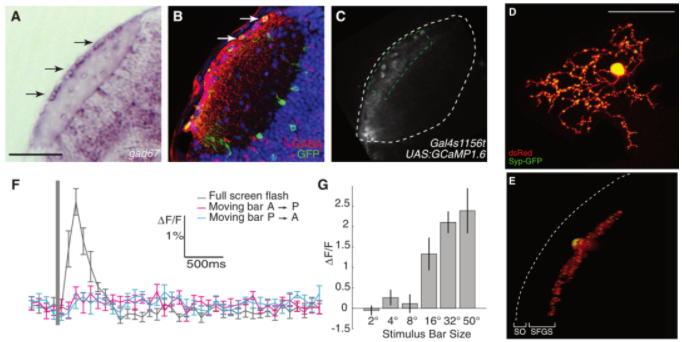
OT浅层的SIN会接受来自大光点的刺激,并在SO和SFG两层产生抑制性递质GABA,使OT浅层对小光点刺激的反应更强烈,这使得斑马鱼的SIN能够通过过滤掉环境中的低频信息,更好的在背景中追踪移动的小型猎物[17,18]。
OT深层的PVN占OT脑区神经元的绝大多数,OT作为斑马鱼大脑中最大的脑区,也是视觉信息处理的中枢,PVN如何解码来自RGC的视觉输入成了一个被广泛关注的科学问题。去年起对PVN结构功能分布的拓扑结构有了一个比较系统的认识,研究[19,20,21]发现位置较尾侧的PVN会接受5°小光点和方向选择性信息的输入;靠头侧的PVN会接受30°大光点的信息输入,而损毁掉对小光点刺激有反应的AF7区域后,尾侧PVN对小光点的反应降低,捕食能力也会受到影响。
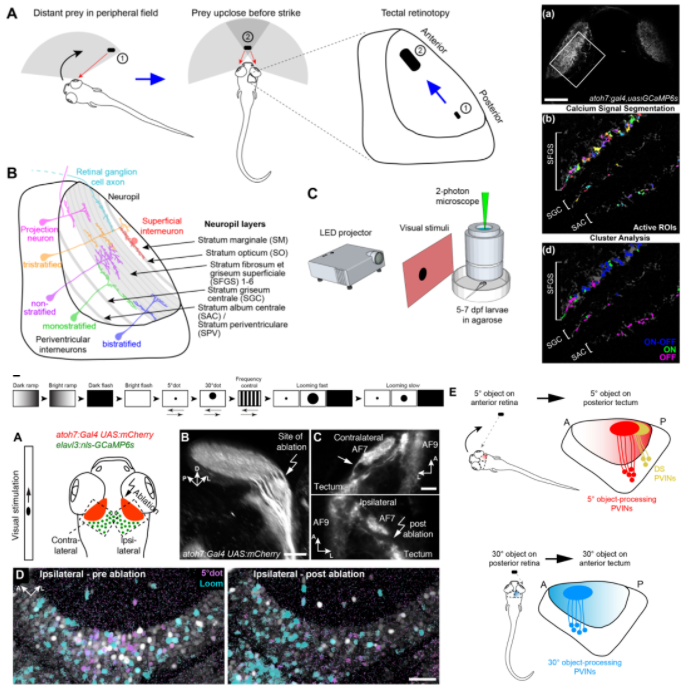
光遗传学激活PVN的行为学实验[22]表明激活头侧的PVN会引起捕食样的J形甩尾,激活尾侧的PVN会引起逃跑样的C形甩尾,这意味着编码looming视觉刺激输入的PVN可能偏尾侧,而编码prey的PVN可能偏头侧。
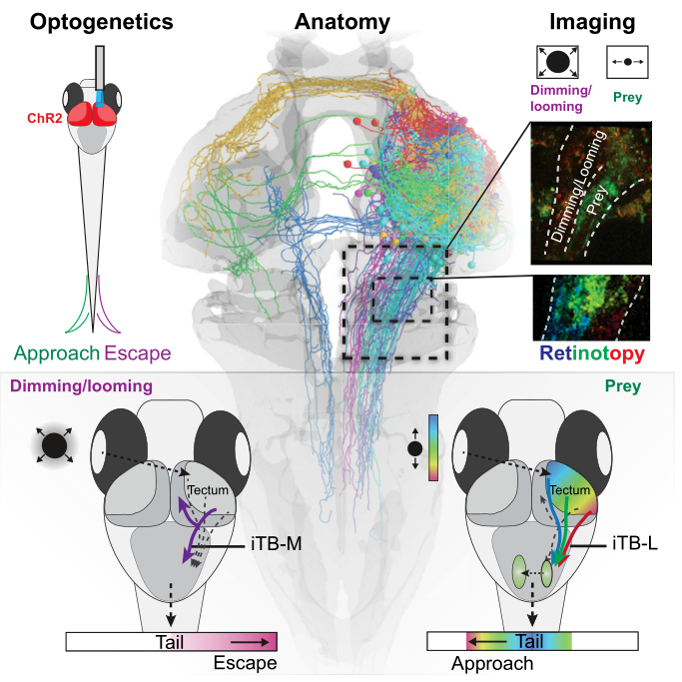
之前提到大小鼠上的视上丘SC是斑马鱼OT的同源脑区,那么是不是意味着光激活SC也能引发大小鼠的捕食和逃跑行为呢?想法很棒!可惜已经有人完成了这个实验:2015年的Science[23]报道了激活SC可以引起小鼠的恐惧和逃跑行为;2019年的Nature Neuroscience[24]工作报道了激活SC可以引起小鼠捕食行为。如果低一级动物的某个脑区在进化上是高度保守的话,那么高一级动物的同源脑区很可能也会有这部分的相关功能,这也是目前比较神经生物学正在做的。
当然,在OT上的工作远不止于此,对自发活动的产生和作用的机制研究也有很多[25,26]:有研究双眼竞争机制的[27],有研究运动方位和速度检测的[28,29],也有发现新的神经元类型对视觉输入有干预的[30]等等。未来的工作也会更多的对OT各层发挥着什么样的功能,会有什么样的神经元参与到视觉信息的调控中来进行进一步的探索。
文章最后我再提个个人观点,抛砖引玉,欢迎各位在评论区讨论!观点图示如下:
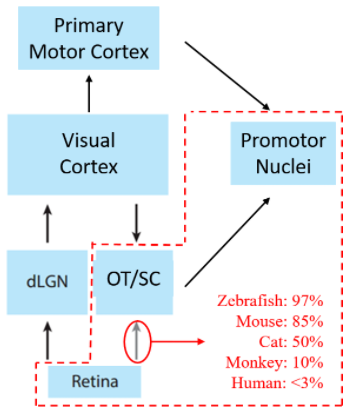
红色虚线部分是斑马鱼这类低等脊椎动物具有的脑区,虚线外的是人类等高级动物才具有的脑区,目前已知从视网膜到视顶盖或是视上丘的投射在鱼中为97%,鼠85%,猫50%,猴10%,人<3%,而顶盖和上丘所介导的运动相对简单,比如捕食,逃跑等,可以看出动物越高等,视觉信息流向顶盖/上丘的越少,流向视皮层的越多。可能是在进化过程中随着鱼进化为两栖再到爬行,陆地上的视觉环境信息以及地形越来越丰富,已有的生物大脑框架变得越来越落后,于是不得已只能在原有底层框架不变的情况下加入一个视觉信息输入的新框架,就有了视皮层,并且为了更好的适应各项任务不断的把皮层做深做大,为了更好的执行任务,就有了运动相关的皮层,最后发展到了今天人类这么大的皮层。像不像今天人工智能领域里,三层的全连接网络(类似鱼脑)能很好的解决手写数字集的分类,但遇到更复杂的分类任务时全连接网络就很落伍了,随后发展出了卷积神经网络的框架(CNN,类似皮层),并且在这基础上不断调参加各种新的隐含层进去以适应更难的任务(类似于皮层变厚的过程),最后有了人类这种复杂的生物。
要像大自然这位伟大的调参侠一样设计出类人脑的神经网络,我的解题思路是先搞清楚最基本的计算框架,利用脑图谱数据搞清楚神经元各个节点的连接情况,然后分别在视听觉的几个感觉隐含层疯狂加层提升感知力,在运动的输出层也疯狂加node数提高输出维度,最后额外加一个类似前额叶的“认知层”,需要通过各种复杂的多感知任务不停灌数据来训练出一个通用层,或许最后就能产生一个较为通用的AI了。
欢迎大家关注我们的公众号森林鱼塘,定期更新神经科学小知识:
参考文献:
[1] J. H. Bollmann, The Zebrafish Visual System: From Circuits to Behavior, Annual Review of Vision Science,2019.
[2] M. D. Abràmoff, Retinal Imaging and Image Analysis, IEEE Trans Med Imagin,2010
[3] J. R. Sanes1, and S. L. Zipursky, Design Principles of Insect and Vertebrate Visual Systems, Neuron, 2010
[4] M.Y. Zhou, T. Baden, Zebrafish Retinal Ganglion Cells Asymmetrically Encode Spectral and Temporal Information across Visual Space, Current Biology, 2020
[5] R. H. Masland, The Neuronal Organization of the Retina, Neuron, 2012
[6] Y. Kölsch, H. Baier, Molecular classification of zebrafish retinal ganglion cells links genes to cell types to behavior, Neuron, 2020
[7] E. Robles, H. Baier, The Retinal Projectome Reveals Brain-Area-Specific Visual Representations Generated by Ganglion Cell Diversity, Current Biology, 2014
[8] Fraley, S.M., and Sharma, S.C. Topography of retinal axons in the diencephalon of goldfish. Cell Tissue Res. 1984.
[9] B.B. Zhang, J.L. Du, Left Habenula Mediates Light-Preference Behavior in Zebrafish via an Asymmetrical Visual Pathway. Neuron. 2017.
[10] A. Kramer, H. Baier, Neuronal Architecture of a Visual Center that Processes Optic Flow. Neuron. 2019.
[11] Kun W., A. B. Arrenberg , Selective processing of all rotational and translational optic flow directions in the zebrafish pretectum and tectum. BMC Biology. 2019
[12] X.F Shi, J.H. Cang, Retinal origin of direction selectivity in the superior colliculus. Nature Neuroscience. 2017.
[13] J. L. Semmelhack, H. Baier, A dedicated visual pathway for prey detection in larval zebrafish, eLIFE, 2014.
[14] I. Temizer., J. L. Semmelhack, A Visual Pathway for Looming-Evoked Escape in Larval Zebrafish. Current Biology. 2015.
[15] M. B. Orger, The Cellular Organization of Zebrafish Visuomotor Circuits. Current Biology. 2016.
[16] Y. Kolsch, Molecular classification of zebrafish retinal ganglion cells links genes to cell types to behavior. Neuron. 2021.
[17] F. D. Bene, H. Baier, Filtering of Visual Information in the Tectum by an Identified Neural Circuit. SCIENCE. 2010.
[18] S. J. Preuss, J. H. Bollmann, Classification of Object Size in Retinotectal Microcircuits. Current Biology. 2014.
[19] D. Forster, H. Baier, Retinotectal circuitry of larval zebrafish is adapted to detection and pursuit of prey. eLife. 2020.
[20] E. Robles, H. Baier, The zebrafish visual system transmits dimming information via multiple segregated pathways. J Comp Neurol. 2021
[21] D. Forster, H. Baier, Retinotectal circuitry of larval zebrafish is adapted to detection and pursuit of prey. eLife. 2020.
[22] T. O. Helmbrecht, H. Baier, Topography of a Visuomotor Transformation. Neuron . 2018.
[23]C. P. Shang, P. Chao, A parvalbumin-positive excitatory visual pathway to trigger fear responses in mice. SCIENCE. 2015.
[24] C. P. Shang, P. Chao, A subcortical excitatory circuit for sensory-triggered predatory hunting in mice. Nature Neuroscience. 2019.
[25] G. Sumbre. Principles of Functional Circuit Connectivity: Insights From Spontaneous Activity in the Zebrafish Optic Tectum. Frontiers in Neural Circuits. 2018.
[26] S.A. Romano, G. Sumbre. Spontaneous Neuronal Network Dynamics Reveal Circuit’s Functional Adaptations for Behavior. Neuron. 2015
[27] A. M. Fernandes, H. Baier Neural circuitry for stimulus selection in the zebrafish visual system. Neuron . 2021.
[28] C. Yin, J.L. Du, Optic tectal superficial interneurons detect motion in larval zebrafish. Protein & Cell. 2019.
[29] T.W. Dunn, F. Engert, Neural Circuits Underlying Visually Evoked Escapes in Larval Zebrafish. Neuron. 2016.
[30] E. Robles. Pyramidal Neurons of the Zebrafish Tectum Receive Highly Convergent Input From Torus Longitudinalis. Frontiers in Neuroanatomy. 2021.
相关内容
- 《魔兽世界》9.0,噬渊特殊声望威娜莉该怎么刷?
- 魔兽世界肯瑞托声望怎么刷 WLK肯瑞托声望冲崇拜攻略
- 魔兽世界肯瑞托声望怎么刷 WLK肯瑞托声望冲崇拜攻略
- 魔兽世界肯瑞托声望怎么刷 WLK肯瑞托声望冲崇拜攻略
- 魔兽世界10.0黑龙声望拉希奥以及萨贝里安速刷攻略 黑龙声望怎么刷
- 魔兽世界10.0黑龙声望怎么刷 黑龙声望速刷超详细攻略
- 魔兽世界10.0钴蓝集所声望怎么刷快 钴蓝集所声望速刷攻略
- 魔兽世界10.0钴蓝集所声望怎么刷快 钴蓝集所声望速刷攻略
- 魔兽世界10.0拉希奥和萨贝里安声望怎么刷 黑龙声望速刷攻略
- 魔兽世界10.0拉希奥和萨贝里安声望怎么刷 黑龙声望速刷攻略
- 魔兽世界10.0工匠联盟声望怎么刷 工匠联盟声望速刷攻略
- 魔兽世界10.0工匠联盟声望怎么刷 工匠联盟声望速刷攻略




